2023-10-12
恒瑞创新药氟唑帕利联合阿帕替尼治疗卵巢癌和乳腺癌研究发表于BMC Medicine
内容来源:爱医时空
近日,恒瑞医药创新药氟唑帕利(艾瑞颐®)联合阿帕替尼(艾坦®)治疗晚期卵巢癌和三阴性乳腺癌的I期研究结果发表于《BMC Medicine》(IF:9.3)[1],该研究由北京大学肿瘤医院李惠平教授和高雨农教授团队共同开展。研究结果显示,在最高剂量水平,即氟唑帕利100mg联合阿帕替尼500mg治疗组中,客观缓解率(ORR)为50%;gBRCA突变的患者ORR和中位无进展生存期(PFS)均优于gBRCA野生型患者。氟唑帕利联合阿帕替尼治疗晚期卵巢癌或三阴性乳腺癌患者安全性良好,该联合治疗可作为化疗潜在替代方案进一步探索。

氟唑帕利联合阿帕替尼治疗晚期卵巢癌和三阴性乳腺癌I期研究发表于《BMC medicine》
研究背景
PARP抑制剂目前用于HER2-乳腺癌的治疗,以及对铂类化疗缓解后的卵巢癌维持治疗[2-4]。为了进一步扩大可能受益于PARP抑制剂的患者人群(例如铂耐药、非BRCA突变的患者),并且避免重复使用铂类化疗的毒性,需要探索有效的无化疗治疗方案。抗血管生成药物可以引起肿瘤微环境缺氧,导致遗传不稳定性和BRCA1/2的下调,从而增强对PARP抑制剂的敏感性[4-7]。在既往研究中,已证明抗血管生成药物联合PARP抑制剂,可改善患者PFS[8-10]。
氟唑帕利是恒瑞医药研发的1类创新药,是我国首个拥有知识产权的PARP抑制剂。在中国获批用于胚系BRCA1/2(gBRCA1/2)突变的铂敏感复发性卵巢癌治疗,以及铂类敏感复发性卵巢癌维持治疗,无论胚系BRCA1/2突变状态如何[11-13]。阿帕替尼是恒瑞医药历时10年研发的具有自主知识产权的1类创新药,是一种高选择性的靶向血管内皮细胞生长因子受体2(VEGFR2)的抗血管生成药物。它在卵巢癌和乳腺癌等多种实体肿瘤中均显示良好的活性和安全性[14-17]。
目前,氟唑帕利和阿帕替尼的口服联合用药正在临床研发中,旨在提高治疗的便利性,规避常规化疗带来的损伤及毒副反应。
研究设计
本研究是一项多中心、开放标签、剂量递增和药代动力学扩展的I期研究(NCT03075462)。主要入组标准为:经组织学确诊的晚期高级别浆液性卵巢癌、输卵管癌或原发性腹膜癌(伴有或不伴有gBRCA突变)或三阴性乳腺癌患者。卵巢癌患者既往接受过2-4线含铂化疗,铂敏感或铂耐药患者均可入组。三阴性乳腺癌患者既往接受≤2线化疗,且在末次抗肿瘤期间或之后疾病进展或复发。排除既往使用PARP抑制剂或抗血管生成抑制剂的患者。
研究采用标准的3+3剂量递增设计:氟唑帕利的剂量为40-100mg(bid),阿帕替尼的剂量为250mg、375mg和500mg(qd)。主要终点是确定氟唑帕利联合阿帕替尼治疗的推荐Ⅱ期剂量(RP2D)和耐受性。次要终点包括最佳总体反应、ORR和疾病控制率(DCR),糖类抗原125(CA-125)反应等。
研究结果
2017年3月17日至2021年3月2日期间,共有52例患者入组:剂量递增队列27例,PK拓展队列25例。其中,包括30例卵巢癌患者和22例三阴性乳腺癌患者。截至2021年8月22日,中位随访时间11.3个月。
在所有剂量水平中,52例患者中5例(9.6%)完全缓解(CR),14例(26.9%)部分缓解(PR),15例(28.8%)疾病稳定(SD)。氟唑帕利100mg联合阿帕替尼500mg最高剂量水平,ORR为50.0%,DCR为62.5%。
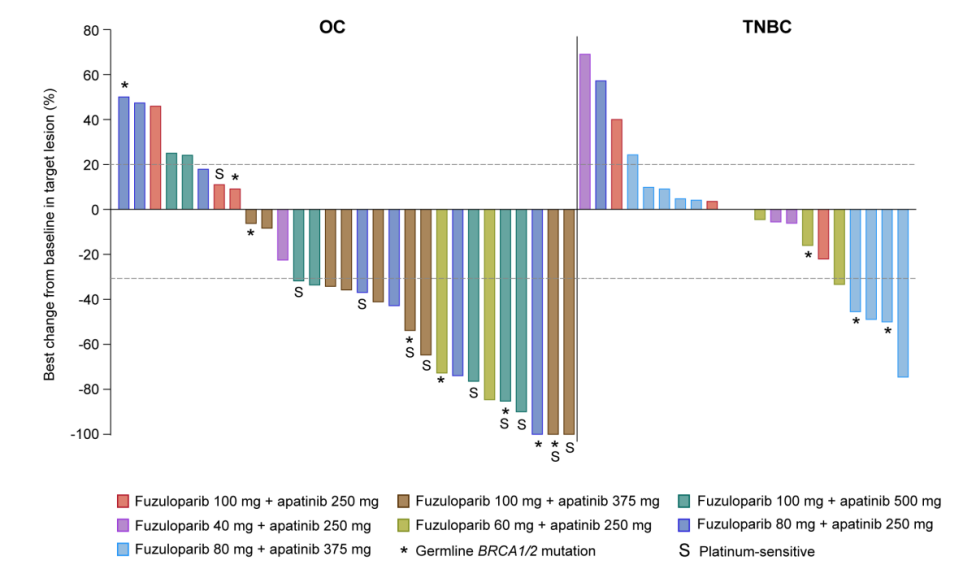
卵巢癌(OC)和三阴性乳腺癌(TNBC)靶病灶最佳反应
伴有gBRCA1/2突变的卵巢癌患者中位PFS为9.4个月,gBRCA野生型的卵巢癌患者中位PFS为6.7个月。伴有gBRCA1/2突变的三阴性乳腺癌患者的中位PFS为5.5个月,gBRCA野生型三阴性乳腺癌患者中位PFS为2.8个月。
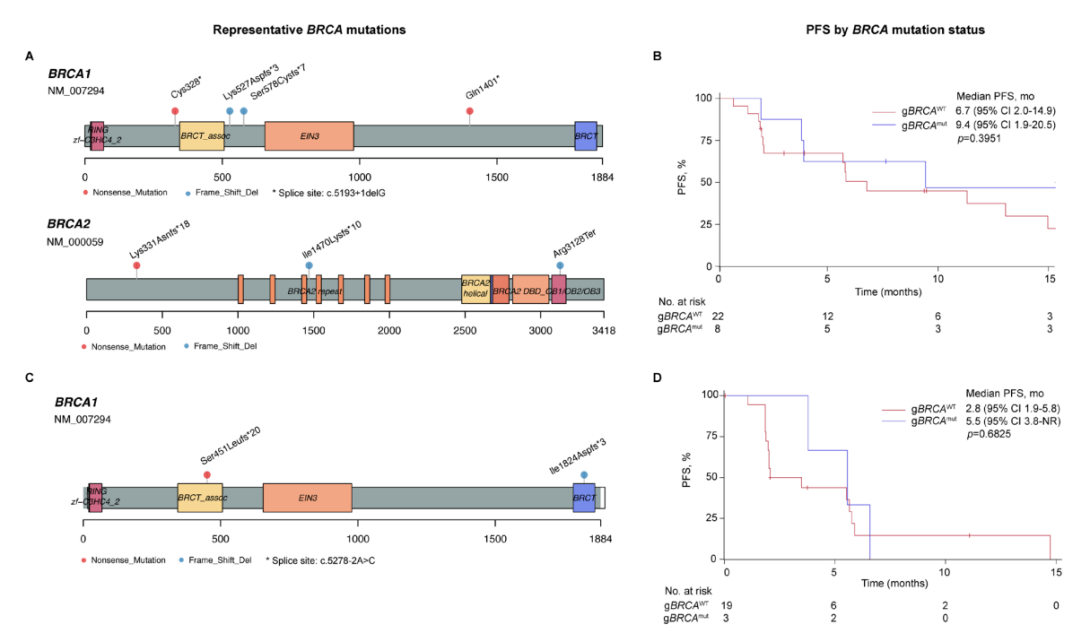
gBRCA突变患者与gBRCA野生型患者疗效(卵巢癌患者A、B,三阴性乳腺癌患者C、D)
研究结论
在复发性卵巢癌和三阴性乳腺癌患者中,氟唑帕利联合阿帕替尼安全性可控,对晚期卵巢癌和三阴性乳腺癌具有良好的抗肿瘤活性,为无法耐受细胞毒性治疗的患者带来新的治疗选择。
氟唑帕利和阿帕替尼均是恒瑞医药自主研发的创新药,获批上市以来为广大肿瘤患者带去治疗新希望。作为中国首个自主研发的PARP抑制剂,氟唑帕利已获批上市两款适应症,今年8月,其新适应症上市申请获受理,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌一线维持治疗。除卵巢癌、乳腺癌外,氟唑帕利还在胰腺癌、前列腺癌等瘤种中开展相关研究,其单药或联合阿帕替尼的多个适应症开发已处在III期临床研究阶段,另有多种联合治疗方案,包括与阿比特龙、与SHR-A1811、与mFOLFIRINOX等联合治疗多种实体肿瘤已处于临床开发阶段。2014年10月获批上市的阿帕替尼,目前已有3个适应症获批,分别为单药用于晚期胃腺癌或胃-食管结合部腺癌、既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌、联合卡瑞利珠单抗用于不可切除或转移性肝细胞癌。前不久,卡瑞利珠单抗(艾瑞卡®)联合阿帕替尼(艾坦®)(“双艾”) 肝癌一线治疗适应症美国申报上市获FDA受理,该研究主论文全文在线发表于国际顶级医学期刊《柳叶刀》(The Lancet,IF:168.9)主刊上,这是肿瘤学领域中国学者主导的国际性III期临床研究首次问鼎《柳叶刀》主刊。
作为一家创新型国际化制药企业,恒瑞医药多年来针对中国高发肿瘤领域持续展开技术攻关,在中国获批上市自研创新药13款、引进创新药2款,其中肿瘤创新药达9款。未来,恒瑞医药将继续深入实施科技创新和国际化双轮驱动发展战略,立足民生需求,争分夺秒推进创新药研发,努力研制出更多的新药好药,为守护患者健康生活和生命质量作出更大贡献。
参考文献:
[1] Yaxin Liu, Wei Wang,et al. A phase 1 trial of fuzuloparib in combination with apatinib for advanced ovarian and triple negative breast cancer: efficacy, safety, pharmacokinetics and germline BRCA mutation analysis.
[2] Vanacker H, Harter P, Labidi-Galy SI, Banerjee S, Oaknin A, Lorusso D, et al. PARPinhibitors in epithelial ovarian cancer: Actual positioning and future expectations. Cancer Treat Rev. 2021; 99:102255.
[3] Mirza MR, Pignata S, Ledermann JA. Latest clinical evidence and further development of PARP inhibitors in ovarian cancer. Ann Oncol. 2018; 29:1366-76.
[4] Bianchini G, De Angelis C, Licata L, Gianni L. Treatment landscape of triple-negative breast cancer - expanded options, evolving needs. Nat Rev Clin Oncol. 2022; 19:91-113.
[5] Lim JJ, Yang K, Taylor-Harding B, Wiedemeyer WR, Buckanovich RJ. VEGFR3 inhibition chemosensitizes ovarian cancer stemlike cells through down-regulation of BRCA1 and BRCA2. Neoplasia. 2014; 16:343-353.e341-2.
[6] Bindra RS, Crosby ME, Glazer PM. Regulation of DNA repair in hypoxic cancer cells. Cancer Metastasis Rev. 2007; 26:249-60.
[7] Bindra RS, Gibson SL, Meng A, Westermark U, Jasin M, Pierce AJ, et al. Hypoxiainduced down-regulation of BRCA1 expression by E2Fs. Cancer Res. 2005; 65:11597-604.
[8] Liu JF, Barry WT, Birrer M, Lee JM, Buckanovich RJ, Fleming GF, et al. Overall survival and updated progression-free survival outcomes in a randomized phase II study of combination cediranib and olaparib versus olaparib in relapsed platinum-sensitive ovarian cancer. Ann Oncol. 2019; 30:551-7.
[9] Mirza MR, Åvall Lundqvist E, Birrer MJ, dePont Christensen R, Nyvang GB, Malander S, et al. Niraparib plus bevacizumab versus niraparib alone for platinum-sensitive recurrent ovarian cancer (NSGO-AVANOVA2/ENGOT-ov24): a randomised, phase 2, superiority trial. Lancet Oncol. 2019; 20:1409-19.
[10] Liu JF, Barry WT, Birrer M, Lee JM, Buckanovich RJ, Fleming GF, et al. Combination cediranib and olaparib versus olaparib alone for women with recurrent platinum-sensitive ovaria
[11] Li N, Bu H, Liu J, Zhu J, Zhou Q, Wang L, et al. An open-label, multicenter, single-arm, phase II study of fluzoparib in patients with germline BRCA1/2 mutation and platinumsensitive recurrent ovarian cancer. Clin Cancer Res. 2021; 27:2452-8.
[12] Li N, Zhang Y, Wang J, Zhu J, Wang L, Wu X, et al. Fuzuloparib maintenance therapy in patients with platinum-sensitive, recurrent ovarian carcinoma (FZOCUS-2): a multicenter, randomized, double-blind, placebo-controlled, phase III trial. J Clin Oncol. 2022:Jco2101511.
[13] Li H, Liu R, Shao B, Ran R, Song G, Wang K, et al. Phase I dose-escalation and expansion study of PARP inhibitor, fluzoparib (SHR3162), in patients with advanced solid tumors. Chin J Cancer Res. 2020; 32:370-82.
[14] Li J, Qin S, Xu J, Xiong J, Wu C, Bai Y, et al. Randomized, double-blind, placebocontrolled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction. J Clin Oncol. 2016; 34:1448-54.
[15] Qin S, Li Q, Gu S, Chen X, Lin L, Wang Z, et al. Apatinib as second-line or later therapy in patients with advanced hepatocellular carcinoma (AHELP): a multicentre, doubleblind,randomised, placebo-controlled, phase 3 trial. Lancet Gastroenterol Hepatol. 2021; 6:559-68.
[16] Hu N, Zhu A, Si Y, Yue J, Wang X, Wang J, et al. A phase II, single-arm study of apatinib and oral etoposide in heavily pre-treated metastatic breast cancer. Front Oncol. 2020; 10:565384.
[17] Lan C-Y, Wang Y, Xiong Y, Li J-D, Shen J-X, Li Y-F, et al. Apatinib combined with oral etoposide in patients with platinum-resistant or platinum-refractory ovarian cancer (AEROC): a phase 2, single-arm, prospective study. Lancet Oncol. 2018; 19:1239-46.