2024-01-08
胰腺癌治疗新选择,恒瑞医药盐酸伊立替康脂质体注射液(II)获批上市
近日,恒瑞医药收到国家药品监督管理局核准签发的《药品注册证书》,批准公司自主研发的盐酸伊立替康脂质体注射液(II)(商标名:越优力®)上市,本品联合氟尿嘧啶(5-FU)和亚叶酸钙(LV),用于既往经吉西他滨为基础的化疗治疗失败的不可切除的局部晚期或转移性胰腺癌患者的治疗。

本品开展的一项随机、双盲、平行对照、多中心III期临床研究(PAN-HEROIC-1)研究结果表明,盐酸伊立替康脂质体(II)联合5-FU/LV对比安慰剂联合5-FU/LV可显著延长患者总生存期(OS)1。
胰腺癌是临床常见的消化系统恶性肿瘤,起病隐匿、恶性程度高,多数患者确诊即为晚期,复发转移率高、死亡率高,患者5年生存率(<8%)远低于其他恶性肿瘤,2020年全球胰腺癌死亡病例46.6万例,在所有恶性肿瘤中排第7位2。
局部晚期和转移性胰腺癌患者掣肘于极有限的药物选择及疗效,其生存期短、生活质量低,5年生存率不足10%3,特别在二线治疗中,仍缺乏中国人群大样本注册研究证据,所以该患者人群对新的治疗方案的需求更加迫切。
伊立替康作为拓扑异构酶I抑制剂,可以在体内羧酸酯酶的作用下转化成活性代谢产物SN-38,并与拓扑异构酶复合物结合,阻止DNA超螺旋结构断裂单链的再连接,导致DNA断裂,促进细胞凋亡,抑制肿瘤发展,伊立替康也因此成为多个经典化疗方案中的基石2,4。但是伊立替康虽已广泛应用于临床,却仍存在药物稳定性差,半衰期不理想,普通剂型的伊立替康很难避免其药物学特性所带来的疗效降低,副作用增多的风险4,增加了临床管理难度,降低了患者的依从性。如何保护药物有效成分,提高稳定性,成为伊立替康降毒增效的关键。
脂质体具有高效低毒、靶向给药等优势,已作为多种药物载体并在临床使用5,6。基于脂质体的优良载药特性,恒瑞医药历经十余年,利用脂质体专利技术将伊立替康包裹进磷脂双分子层中,得到了一种可被动靶向分布于瘤体的新制剂——盐酸伊立替康脂质体(II),其具有以下特性:①通过独有的处方设计筛选和工艺开发,获得高载药量和高包封率的伊立替康脂质体,并具有优良的稳定性7。②聚乙二醇化脂质体表面富集水化层,提供更好的空间阻隔,减少调理素吸附至脂质体表面,屏蔽网状内皮系统的识别和摄取,延长体内循环时间8,9。③通过控制脂质体的粒径<100nm,减少体内清除,延长体内滞留时间,并可更多渗透到肿瘤组织中,达到精准穿透至肿瘤部位的作用10,11。
目前,伊立替康脂质体(II)联合5-FU/LV和奥沙利铂一线治疗胰腺癌的III期临床研究(NCT05751850)也正在开展中,除此之外,伊立替康脂质体(II)也在结直肠癌、食管癌等领域进行探索,未来有望惠及更多消化道肿瘤患者。
作为创新型国际化制药企业,恒瑞医药多年来深入践行“科技为本、为人类创造健康生活”的使命,截至目前已在国内获批上市15款1类创新药、4款自研2类新药。目前,在抗肿瘤领域,公司共有51款创新产品在研。本次,公司盐酸伊立替康脂质体注射液(II)获批,将为胰腺癌患者人群带来更多治疗选择。在胰腺癌治疗领域,公司聚焦未满足的临床需求积极布局,有多个产品正在开展临床试验。
未来,恒瑞医药将继续立足民生需求,争分夺秒推进创新药研发,努力研制出更多的新药好药,服务健康中国,惠及全球患者。
关于PAN-HEROIC-1研究
PAN-HEROIC-1研究是由中国药科大学附属南京天印山医院秦叔逵教授和上海交通大学附属仁济医院王理伟教授牵头开展的多中心、随机、双盲、对照的III期临床研究,旨在评估伊立替康脂质体(II)+5-FU/LV对比安慰剂+5-FU/LV两种方案二线治疗吉西他滨治疗失败后的局晚期/转移性胰腺癌的疗效和安全性。
该研究共纳入298例患者,入组患者按1:1随机接受伊立替康脂质体(II)+5-FU/LV方案或安慰剂+5-FU/LV方案治疗,直至疾病进展或不耐受。主要研究终点为OS,次要研究终点包括PFS、客观缓解率(ORR)等(图1)。中位随访时间为12.81个月,OS数据分析截至2021年11月18日1。
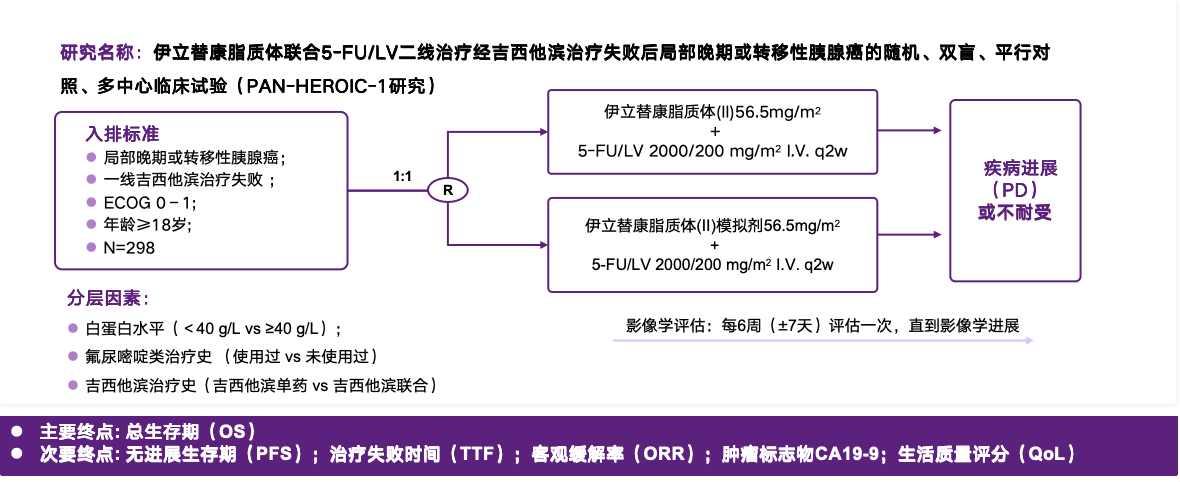
图1:PAN-HEROIC-1研究设计
在2022年欧洲肿瘤内科学会(ESMO)大会上,PAN-HEROIC-1研究结果重磅公布。主要研究终点方面,伊立替康脂质体(II)组较安慰剂组的中位OS显著延长2.4个月(7.39个月vs.4.99个月,HR=0.63,P=0.0019),死亡风险降低了37%1(图2)。
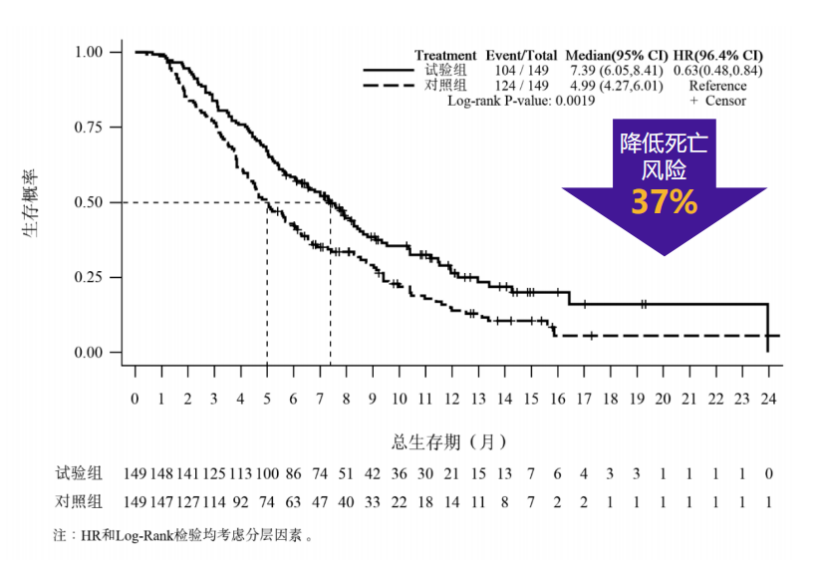
图2:PAN-HEROIC-1研究中位OS结果
次要研究终点PFS,伊立替康脂质体(II)组相对安慰剂组显著延长了2.73个月(4.21个月vs.1.48个月,HR=0.36,P<0.0001),疾病进展和死亡风险降低64%(图3)。
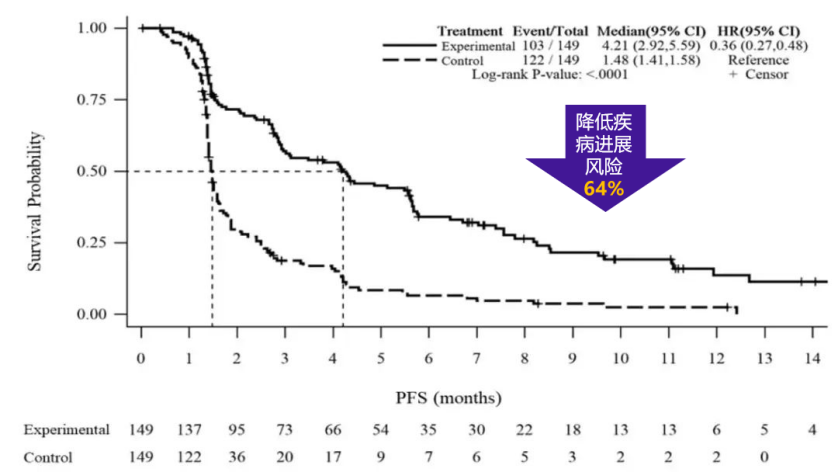
图3:PAN-HEROIC-1研究中位PFS结果
安全性数据方面,非头对头对比伊立替康注射液,伊立替康脂质体(II)出现3级及以上腹泻以及其他不良事件明显减少。
参考文献:
1.L. Wang, et al. 2022 ESMO. LBA61
https://oncologypro.esmo.org/meeting-resources/esmo-congress-2022/hr070803-plus-5-fu-lv-versus-placebo-plus-5-fu-lv-in-second-line-therapy-for-gemcitabine-refractory-locally-advanced-or-metastatic-pancreatic-cance.
2.WHO.Globocan 2020: Available at: https://gco.iarc.fr/today.
3.Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries[J]. The Lancet Global Health, 2018, 6(5): e555-e567.
4.Kciuk M, et al. Int J Mol Sci. 2020;21(14):4919.
5.Guimarães D, et al. Int J Pharm. 2021;601:120571.
6.Bozzuto G, Molinari A. Int J Nanomedicine. 2015;10:975-999.
7.Yang W, Yang Z , Fu J , et al. Biomater Sci. 2018;7(1):419-428.
8.Rommasi F,Esfandiari N.Nanoscale Res Lett. 2021;16(1):95.
9.D'souza AA, Shegokar R. Expert Opin Drug Deliv. 2016;13(9):1257-1275.
10.Danaei M, et al. Pharmaceutics. 2018;10(2):57.
11.Nong J, et al. Adv Drug Deliv Rev. 2022;184:114180.
1.本新闻公告旨在发布研发注册进展信息,仅供中国境内医疗卫生专业人士参阅,非广告用途。
2.恒瑞医药不对任何药品和/或适应症作推荐。
3.本新闻公告中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。医疗卫生专业人士作出的任何与治疗有关的决定应根据患者的具体情况并遵照药品说明书。