2024-01-11
分型精准,未来已来丨FUTURE-SUPER研究荣登《柳叶刀-肿瘤学》,中国医药创新助力晚期TNBC一线迈向精准诊疗
导语:
三阴性乳腺癌(TNBC)约占所有新发乳腺癌的10%-20%,该疾病复发风险高,侵袭性强,被称为“最毒”乳腺癌。三阴性乳腺癌具有高度异质性,传统“一刀切”式的化疗疗效不佳,探索基于分子分型的精准治疗新模式迫在眉睫。复旦大学附属肿瘤医院邵志敏教授团队首先基于中国人群数据绘制基因图谱,提出“复旦分型”,为三阴性乳腺癌精准治疗带来新希望。随后,基于复旦分型的FUTURE系列重磅研究接连问世,FUTURE-C-PLUS研究在一线免疫调节型(IM型)患者中获得了高达81.3%的客观缓解率[1]。

近日,FUTURE系列研究再传喜讯,由复旦大学附属肿瘤医院邵志敏教授、王中华教授团队牵头的FUTURE-SUPER临床试验结果重磅揭晓,充分证实了基于“复旦分型”开展一线精准治疗的有效性和安全性,即将改变TNBC治疗的临床实践。研究结果首先公布于2023年美国临床肿瘤学会(ASCO)年会[2],引发全球学者瞩目。2024年1月9日,该研究以快速通道发表于国际肿瘤学顶刊《柳叶刀-肿瘤学》(The Lancet Oncology,影响因子高达51.1)[3]。
该临床研究也是复旦大学附属肿瘤医院产医融合发展的又一项标志性成果。研究中,一流肿瘤中心的前沿临床试验与恒瑞医药等大型药企的创新药物“无缝衔接”,研究团队“强强联合”,不断挖掘优势治疗靶点、优化治疗策略,最终提升乳腺癌患者预后,实现了从基础到临床的全链条“闭环”创新研究模式。恒瑞医药自主研发的HER1、HER2、HER4酪氨酸激酶抑制剂(TKI)吡咯替尼、人源化PD-1单克隆抗体卡瑞利珠单抗、小分子多靶点酪氨酸激酶抑制剂法米替尼等多款药物共同助力FUTURE系列研究开展,并展现出优良的疗效,为我国TNBC患者带来新的选择。
明确分型,精准施策,
“复旦分型”助力开创TNBC分型精准治疗先河
TNBC因雌、孕激素受体和人表皮生长因子受体2(HER2)的表达均为阴性而得名,在相当长的时间内化疗是主要系统治疗手段。该疾病长期缺乏精准治疗的靶点,临床疗效远比其他类型乳腺癌要差,严重威胁患者的生命健康,其分子本质和治疗策略仍需深入研究。
2019年,邵志敏教授、江一舟教授团队首次绘制出了全球最大规模的“三阴性乳腺癌多组学全景图谱”,结合大样本基因特征、转录组学和临床疗效分析数据,将TNBC细分为具有不同分子特征和治疗靶点的四种亚型,即腔面雄激素受体型(LAR)、免疫调节型(IM)、基底样免疫抑制型(BLIS)、间质型(MES),“复旦分型”由此诞生。随后,邵志敏教授团队在此基础上继续挖掘TNBC潜在治疗靶点并提出精准治疗策略(即“分型精准治疗”)。相关研究发布于国际顶尖学术期刊《癌细胞》(Cancer Cell)杂志[4],入选中国重要医学研究进展,为TNBC的分型精准治疗之路奠定了基础。
靶/免助阵,获益显著,
FUTURE-SUPER研究晚期TNBC一线治疗立新功
为进一步验证“复旦分型”的临床价值,邵志敏教授团队专门开展了FUTURE伞形临床试验系列研究。经分型后,转移性三阴性乳腺癌(mTNBC)患者治疗的客观缓解率(ORR)由既往不足10%被提升至29.8%,其中接受免疫联合治疗(PD-1抑制剂+白蛋白结合型紫杉醇)的IM患者的ORR达43.5%,这些结果提示基于亚型的治疗策略在临床上是可行的。
FUTURE研究的成功,打开了以“复旦分型”为基础的精准诊疗策略探索思路。研究团队乘胜追击,进一步将该分型的应用前移至晚期TNBC的一线治疗领域,FUTURE-SUPER随机对照伞形临床试验就此展开,并取得了令人惊喜的成果。
FUTURE-SUPER研究是一项针对mTNBC一线治疗的随机对照伞型II期试验,旨在进一步评估基于分子亚型和基因组标志物的精准治疗在mTNBC一线治疗中的疗效。研究共入组139例mTNBC或局部晚期无法手术的患者,根据TNBC亚型和基因组生物标志物分为5个治疗臂,并按1:1随机接受白蛋白结合型紫杉醇(Nab-P)的标准化疗(对照组)或Nab-P联合靶向/免疫药物精准治疗(精准治疗组),具体方案如图1。主要研究终点为无进展生存期(PFS),次要研究终点包括每个队列中的PFS、ORR、总生存期(OS)和安全性。
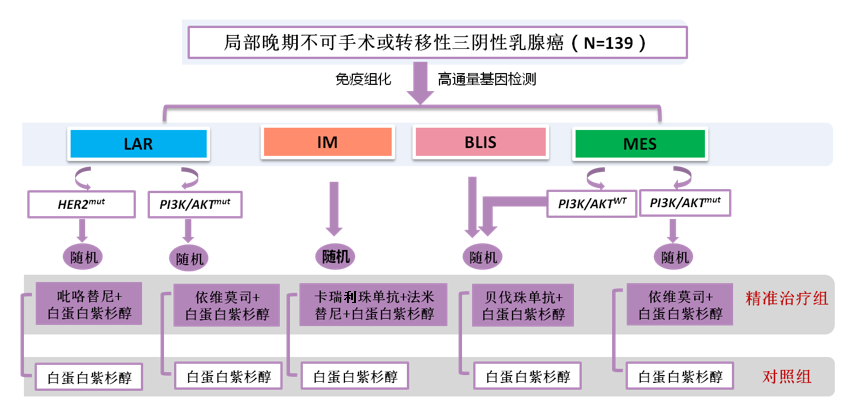
图1 研究设计
结果显示,在为期22.5个月的中位随访期内,精准治疗组的中位PFS显著长于对照组(11.3个月 vs 5.8个月)(图2),其中,IM亚型(Nab-P+法米替尼+卡瑞利珠单抗对比Nab-P)是中位PFS获益幅度最大的亚型,绝对获益高达8.6个月(15.1个月 vs 6.5个月)(图3A),是目前已知国际国内最佳生存获益[5]。其次BLIS/MES-PI3K/AKTWT组中位PFS获益5.2个月(9.1个月vs 3.9个月)(图3B),打破了靶向治疗在TNBC中的使用限制。此外,精准治疗组的ORR高达80%,显著高于对照组的44.8%。大多数不良事件为1-2级,进一步的高通量生物标志物分析正在进行中,有望为患者的精准治疗提供更多参考。
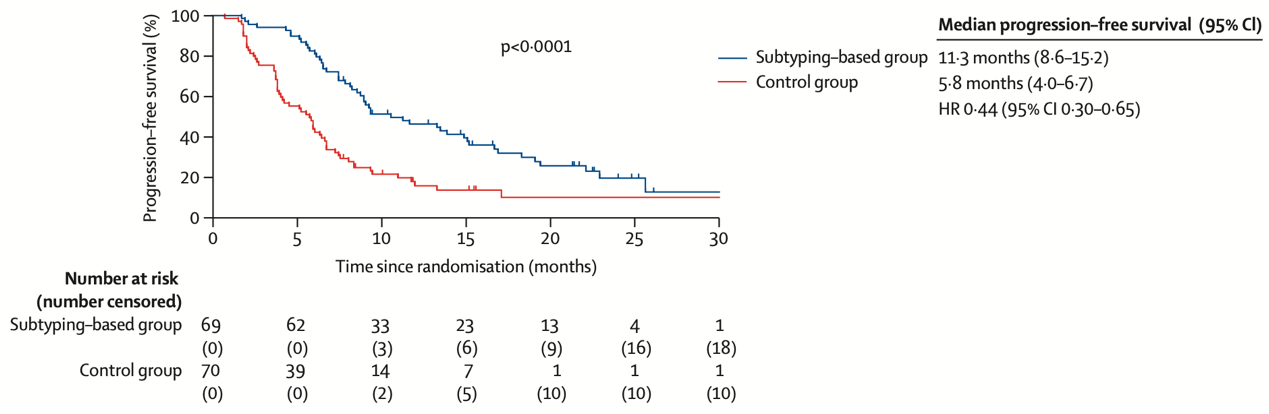
图2 全体人群的无进展生存数据
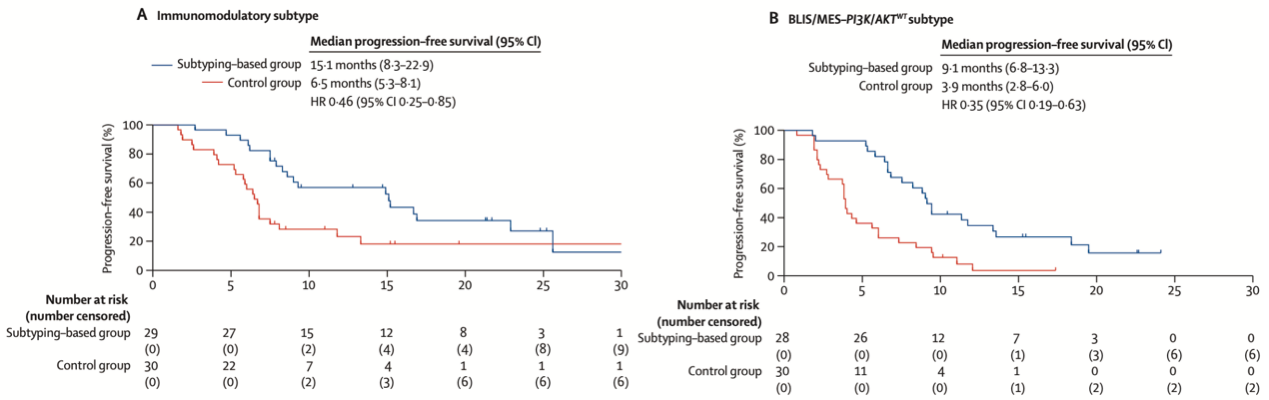
图3 IM与BLIS/MES-PI3K/AKTWT人群的无进展生存数据
文章第一作者范蕾教授认为,FUTURE-SUPER研究的最大突破在于改变了晚期TNBC一线治疗的理念,基于分子亚型和基因组标志物的精准治疗策略相比于传统化疗方案,显著延长了mTNBC一线治疗的PFS,且毒性可控。TNBC患者的治疗选择不再仅仅局限于化疗药物,基于分子亚型和基因组标志物选用化疗联合免疫/靶向等治疗方案为mTNBC患者带来福音。特别是化疗联合免疫及靶向的三联方案在IM型mTNBC患者展现了优异疗效与可控的安全性,为临床上提供了更加丰富的选择。同时,FUTURE-SUPER研究的成功落地,实现了从基础到临床的全链条“闭环”创新研究模式,充分证明了根据“复旦分型”对TNBC治疗方案进行优化具有重要的临床意义。本次FUTURE-SUPER研究的成功也得益于本土药企恒瑞公司的大力支持,持续为研究平台提供优秀的创新药物。FUTURE-SUPER的成功也使其成为医院与药厂合作完成研究者发起的临床研究(Investigator-initiated trial, IIT)的典范。
多款恒瑞产品助力FUTURE系列研究,
未来可期
吡咯替尼是恒瑞医药自主研发并拥有知识产权的口服HER1、HER2、HER4酪氨酸激酶抑制剂(TKI),也是在中国实体瘤领域首个凭借II期临床研究有条件批准上市的1.1类创新药,随后多项III期研究也充分证明了吡咯替尼能够为HER2阳性乳腺癌患者带来获益。在FUTURE-SUPER研究HER2突变队列中吡咯替尼联合白紫显示出具有潜力的疗效。卡瑞利珠单抗是恒瑞医药自主研发并拥有知识产权的人源化PD-1单克隆抗体,2019年5月获批上市以来,已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批9个适应症。法米替尼同样是恒瑞自主研发的小分子多靶点酪氨酸激酶抑制剂,法米替尼新药上市申请以及卡瑞利珠单抗新适应症上市申请均获受理,本次申报适应症为卡瑞利珠单抗联合法米替尼二线治疗宫颈癌,该适应症已被CDE纳入突破性疗法。在FUTURE-SUPER研究IM亚型中卡瑞利珠单抗联合法米替尼和白紫的PFS获益幅度最大,与FUTURE-C-PLUS研究相辅相成,共同助力此治疗组合在mTNBC的应用。
作为创新型国际化制药企业,恒瑞医药多年来深入践行“科技为本、为人类创造健康生活”的使命,目前,在抗肿瘤领域,公司共有51款创新产品在研。未来,恒瑞医药将继续坚持“以患者为中心”的理念,重创新,强研发,力争研制出更多更好的新药,服务健康中国,惠及全球患者。
总结
三阴性乳腺癌复发风险高,预后差,且具有高度的异质性,传统化疗策略难以满足临床需求;基于“复旦分型”的精准治疗策略正在突破疗效瓶颈,有望引领乳腺癌诊疗模式的又一次变革。作为国内乳腺癌治疗领域的领军人物之一,邵志敏教授以乳腺癌精准分型探索为目标,多年来带领团队深耕创新,从“复旦分型”到“FUTURE-SUPER”,形成了基础研究向临床转化的完整闭环,充分实现了方案创新、理论创新和合作创新,为患者带来获益的同时,也在国际舞台上发出了响亮的“中国声音”。相信在不久的将来,更多的“中国方案”定会熠熠闪耀,改变乳腺癌的治疗格局。
参考文献:
[1].Chen Li, Jiang YZ, Wu SY, et al. Famitinib with camrelizumab and nab-paclitaxel for advanced immunomodulatory triple-negative breast cancer (FUTURE-C-PLUS): an open-label, single-arm, phase 2 trial. Clin Cancer Res. 2022 Mar 3;clincanres.CCR-21-4313-E.2021.
[2].FUTURE-SUPER: A randomized, subtyping-based umbrella phase II trial for first-line treatment of metastatic triple-negative breast cancer. ASCO 2023:abstract 3011.
[3].Fan, Lei et al.Optimising first-line subtyping-based therapy in triple-negative breast cancer (FUTURE-SUPER): a multi-cohort, randomised, phase 2 trial. The Lancet Oncology,2024
[4].Yi-Zhou Jiang, Ding Ma, Chen Suo, ..., Leming Shi, Wei Huang, Zhi-Ming Shao. (2019). Genomic and Transcriptomic Landscape of Triple-Negative Breast Cancers: Subtypes and Treatment Strategies. Cancer Cell.
[5].非头对头比较
1.本新闻旨在分享研发前沿资讯,仅供医疗卫生专业人士基于学术目的参阅,非广告用途。
2.恒瑞医药不对任何药品和/或适应症作推荐。
3.本文涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。医疗卫生专业人士作出的任何与治疗有关的决定应根据患者的具体情况并遵照药品说明书。